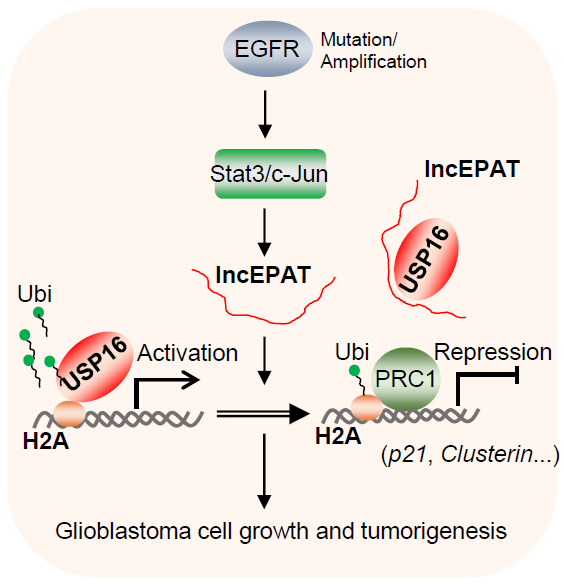
弗吉尼亚联邦大学(VCU)Suyun Huang教授课题组,长期致力于解析表观遗传修饰在胶质瘤发生及肿瘤干细胞形成中所发挥的作用,以期最终筛选出逆转表观遗传修饰能有效治疗GBM的临床药物。与MD安德森癌症中心的Yiwen Chen副教授实验室、VCU梅西癌症中心的Hengbin Wang教授及Jinze Liu教授实验室等合作,揭示了lncEPAT-USP16竞争结合导致USP16从多个衰老基因启动子区的ubH2A修饰位点脱离,进而抑制这些基因的表达并最终促进GBM细胞生长和肿瘤发展进程,相关研究结果以Critical Role of LncEPAT in Coupling Dysregulated EGFR Pathway and Histone H2A Deubiquitination during Glioblastoma Tumorigenesis 为题目,2022年10月5日在线发表于Science Advances。文章在GBM中首次揭示lncRNA参与H2A泛素化修饰水平的维持;同时揭示了H2A泛素化修饰参与EGFR驱动的胶质瘤发生。为解析lncEPAT作为GBM发生的促癌基因的分子机制,结合多种生物学实验,研究人员在细胞水平和活体小鼠模型中对lncEPAT进行了系统的研究,目前结果表明:1. lncPEAT作为中间分子,将失调的EGFR信号通路与组蛋白H2A去泛素化修饰连接起来,作为EGFR信号通路下游的节点分子,表达受STAT3和CJUN转录因子调控。lncEPAT在肿瘤的高表达与胶质瘤分级呈正相关,与病人生存时长呈反相关。2. 质谱分析表明作为ubH2A的去泛素化酶USP16是lncEPAT的特异性互作蛋白。lncEPAT-USP16互作抑制了染色质对USP16蛋白的招募,进而抑制了CDKN1A和CLUSTERIN等衰老基因的表达。3. lncEPAT表达被干扰后,胶质瘤细胞的细胞周期阻滞引发细胞衰老,GBM发展进程受到抑制。EGFR-lncEPAT-ubH2A偶联代表了GBM肿瘤发生过程中表观遗传基因调控和抗衰老的新机制。综上,lncEPAT发挥促进肿瘤发展部分依赖于USP16蛋白,寻找特异的lncEPAT小分子抑制剂,通过抑制由EGFR引发的lncEPAT过表达或能通过促进GBM细胞衰老而达到治疗效果。
原文链接:
http://doi.org/10.1126/sciadv.abn2571